মারাত্মক 'superbugs' আণবিক ড্রিলস দ্বারা ধ্বংস সম্ভব?
প্রকাশন সময়ঃ ডিসেম্বর ১২, ২০১৯
উৎসঃ Rice University
রাইস ইউনিভার্সিটি, টেক্সাসের এএন্ডএম বিশ্ববিদ্যালয়, বায়োলা বিশ্ববিদ্যালয় এবং ডারহাম (ইউকে) বিশ্ববিদ্যালয়ের গবেষকরা দেখিয়েছেন যে রসায়নবিদ জেমস টুরের রাইস ল্যাবে বিকশিত মোটরযুক্ত অণুগুলি কয়েক মিনিটের মধ্যেই অ্যান্টিবায়োটিক-প্রতিরোধী জীবাণুগুলিকে মেরে ফেলতে কার্যকর।
ট্যুর বলেছিলেন, "এই সুপারব্যাগগুলি ক্যান্সারকে ছাড়িয়ে যাওয়ার পথে ২০৫০ সালের মধ্যে এক বছরে ১০ কোটির মানুষকে হত্যা করতে সক্ষম," "এগুলি প্রচণ্ড আতঙ্কিত ব্যাকটিরিয়া; তারা কোনও কিছুর প্রতি প্রতিক্রিয়া দেখায় না"
মোটর অণুগুলি ব্যাকটিরিয়াগুলিকে লক্ষ্য করে এবং যখনই আলোর সাহায্যে সক্রিয় হয়ে উঠে তখনি বহিরাবরণে গর্ত সৃষ্টি করতে সক্ষম হয়।
যখন ব্যক্টেরিয়া antibiotics গুলোর প্রতি প্রতিরোধ সৃষ্টি শুরু করে, তার তৈরি পদ্ধতি দ্বারা তখন ব্যক্টেরিয়ার আণবিক ড্রিলের বিরুদ্ধে কোনও প্রতিরক্ষা থাকে না। Antibiotics তখন নির্ধারিত ব্যক্টেরিয়ায় ড্রিল দ্বারা ছিদ্রে করার মাধ্যমে ভিতরে প্রবেশ করতে সক্ষম ।
আমেরিকান কেমিক্যাল সোসাইটি জার্নাল ACS Nano'তে গবেষকরা তাদের ফলাফলের কথা জানিয়েছেন।
ট্যুর এবং রবার্ট পাল, ডারহামের রয়েল সোসাইটি বিশ্ববিদ্যালয় গবেষণা ফেলো এবং নতুন কাগজের সহ-লেখক, ২০১৭ সালে উপস্থাপিত করেন কোষে খনন করার জন্য 'আণবিক ড্রিল পদ্ধতি'
প্যাডেল মত অণুগুলো যা সেকেন্ডে ৩০ লক্ষবার চক্রাকারে পরিভ্রমণ করতে সক্ষম আলোর উপস্থিতিতে.
 শীর্ষস্থানীয় বিজ্ঞানী জেফ্রি সিরিিলো এবং প্রাক্তন ধান গবেষক রিচার্ড গুনাসেকেরার টেক্সাসের এএন্ডএম ল্যাব দ্বারা পরীক্ষিত, কার্যকরভাবে কয়েক মিনিট এর মধ্যে ধ্বংস করে Klebsiella pneumoniae
শীর্ষস্থানীয় বিজ্ঞানী জেফ্রি সিরিিলো এবং প্রাক্তন ধান গবেষক রিচার্ড গুনাসেকেরার টেক্সাসের এএন্ডএম ল্যাব দ্বারা পরীক্ষিত, কার্যকরভাবে কয়েক মিনিট এর মধ্যে ধ্বংস করে Klebsiella pneumoniae
নির্ধারিত ব্যাকটেরিয়াগুলির মাইক্রোস্কোপিক চিত্রগুলি দেখায়, যেখানে কোষ প্রাচীরে মোটর অণুগুলি কি পরিমাণ ড্রিল করেছিল।
"ব্যাকটেরিয়ার শুধু একটি লিপিড বাইলেয়ার থাকে না," ট্যুর বলেন। "এগুলির সাথে শর্করাযুক্ত দুটি বাইলেয়ার এবং প্রোটিন রয়েছে যা এগুলি সংযুক্ত করে রেখেছে" সুতরাং জিনিসগুলি সাধারণত খুব দৃঢ় কোষ প্রাচীরের মধ্যে দিয়ে প্রবেশ করতে সক্ষম নয়। যে কারণে এই সকল ব্যাকটেরিয়াগুলোকে খুব কঠিন হয় ধ্বংস করতে। তবে এই আণবিক ড্রিলের মতো কোনও মেশিনের বিরুদ্ধে তাদের নিজেদের রক্ষা করার আর কোনও উপায় নেই। যদিও এটি একটি যান্ত্রিক ক্রিয়া এবং কোনও রাসায়নিক প্রভাব নয়।"
মোটর অণুগুলো meropenem এর প্রতি K. pneumonia সংবেদনশীলতাটিকে বাড়িয়ে তোলে, meropenem একটি অ্যান্টিব্যাকটিরিয়াল ড্রাগ যাতে ব্যাক্টেরিয়া প্রতিরোধ গড়ে তুলেছিল। ট্যুর বললেন,
কখনও কখনও, যখন ব্যাকটিরিয়াগুলি ওষুধ এর বৈশিষ্ট্যগুলো বের করার চেষ্টা করে, তখন সেটা প্রবেশ করতে বাধা সৃষ্টি করে। অন্যান্য সময়, ব্যাকটিরিয়া ড্রাগটিকে অক্ষম করে এবং নিষ্ক্রিয় করে ভিতরে প্রবেশের মাধ্যমে পরাস্ত করে ।
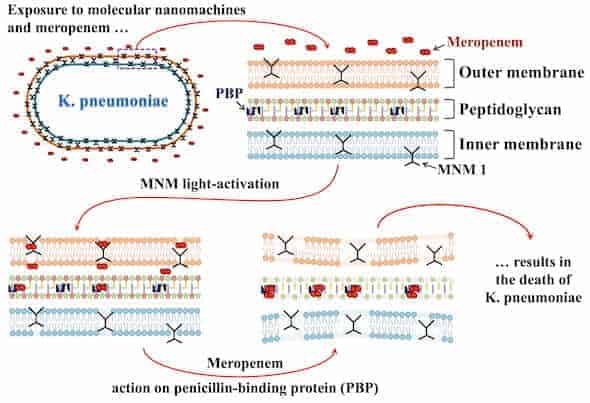

তিনি বলেছিলেন, meropenem পূর্বকালীন একটি উদাহরণ, "এখন আমরা এটা কোষ প্রাচীর মাধ্যমে পেতে পারি," ট্যুর বলেন। "এই আণবিক ড্রিলস সঙ্গে একযোগে তাদের ব্যবহার করে অকার্যকর অ্যান্টিবায়োটিক মধ্যে নতুন জীবনের শ্বাস ফিরে আনতে পারি। "
Gunasekera বলেছিলেন যে ব্যাকটিরিয়া কলোনিগুলো কেবলমাত্র ন্যানোমাইনগুলির সামান্য ঘনত্বের সাথে লক্ষ্য করে কোষগুলি ১৭% পর্যন্ত ধ্বংস করতে সক্ষম হয়েছিল, তবে meropenem সংযোজন করে এটি বেড়েছে ৬৫%। আরও প্রতিমাণ ঠিক রেখে মোটর এবং অ্যান্টিবায়োটিকের পরে, গবেষকরা নিউমোনিয়া সৃষ্টিকারী প্যাথোজেনের ৯৯% ধ্বংস করতে সক্ষম হয়। ট্যুর বলেছিলেন যে ব্যাকটেরিয়াজনিত ত্বক, ক্ষত, ক্যাথেটার বা ইমপ্লান্ট সংক্রমণের চিকিত্সা করার ক্ষেত্রে ন্যানোমাইনগুলি তাদের তাৎক্ষণিক প্রভাব দেখাতে পারে, যেমন, staphylococcus aureus MRSA, klebsiella or pseudomonas -- and intestinal infections এর মত।
"ত্বকে, ফুসফুসে বা জিআই ট্র্যাক্টে, যেখানেই আমরা আলোক উৎস প্রবর্তন করতে পারি, আমরা এই ব্যাকটিরিয়াকে আক্রমণ করতে পারব," তিনি বলেছিলেন। "বা বাইরের আলোর-সমেত বাক্সের মাধ্যমে রক্ত প্রবাহিত করে এবং তারপরে রক্তবাহিত ব্যাকটিরিয়াকে মেরে ফেলে আবার সেই রক্ত শরীরে ফিরে নিতে পারি।"
"আমরা প্রাথমিকভাবে ক্ষত এবং রোপন সংক্রমণ চিকিত্সা করতে খুব আগ্রহী," সিরিলো বলেছেন। কিন্তু আমাদের উপায় আছে আলোর এই তরঙ্গদৈর্ঘ্য ফুসফুসের সংক্রমণে যা নিউমোনিয়া, সিস্টিক ফাইব্রোসিস এবং যক্ষা থেকে অসংখ্য মৃত্যুর কারণ করে, সরবরাহ করতে। সুতরাং আমরা শ্বাসযন্ত্রের সংক্রমণের চিকিত্সাও বিকাশ করব।'
Gunasekera উল্লেখ করেছেন যে মূত্রাশয়জনিত ব্যাকটিরিয়া যেগুলি মূত্রনালীর সংক্রমণ ঘটায় সেগুলিও লক্ষ্যবস্তু হতে পারে।
Journal Reference:
- Thushara Galbadage, Dongdong Liu, Lawrence B. Alemany, Robert Pal, James M. Tour, Richard S. Gunasekera, Jeffrey D. Cirillo. Molecular Nanomachines Disrupt Bacterial Cell Wall, Increasing Sensitivity of Extensively Drug-Resistant Klebsiella pneumoniae to Meropenem. ACS Nano, 2019; DOI: 10.1021/acsnano.9b07836

No comments: